Szczepionka AstraZeneca (ChAdOx1-S) – analiza preparatu
Szczepionka AstraZeneca (AZD1222, Covishield, Vaxzevria) – wykorzystuje wektor ChAdOx1, który powstał przez modyfikację szympansiego adenowirusa przez naukowców Uniwersytetu Oxfordzkiego i stąd pochodzi nazwa szczepionki ChAdOx1-S (Chimpanzee Adenovirus, Oxford University # 1 Spike, wcześniejsza nazwa ChAdY25-E). Końcówka -S oznacza, że wektor ten posiada wstawkę będącą genem kodującym białko S wirusa SARS-CoV-2 (S- Spike).1
SKŁAD 2
Opakowanie zawiera 8-10 dawek po 0,5 ml zawiesiny do iniekcji o pH 6,6, w której skład wchodzi:
- szczepionka ChAdOx1-S – nie mniej niż 2,5×108 jednostek zakaźnych
Inne składniki szczepionki:
- L-histydyna – aminokwas stanowiący budulec wielu ważnych białek (m.in. hemoglobiny), uczestniczy w powstawaniu histaminy; jest stabilizatorem szczepionki
- Chlorek sodu (NaCl) – pomaga w zachowaniu właściwości szczepionki (np. utrzymanie prawidłowej struktury białek), zapobiega zaburzeniu równowagii jonowej organizmu po podaniu szczepionki (woda pozbawiona jonów zaburza równowagę jonową organizmu)
- Chlorek magnezu (MgCl2) – stabilizator, utrzymuje odpowiednie stężenie jonów (podobnie jak chlorek sodu) i zachowuje odpowiednie właściwości białek (konformację)
- EDTA (kwas edetynowy, wyst. w postaci soli jako wersenian disodowy) – chelator (wiąże jony wielu metali) i składnik stabilizujący właściwości szczepionki
- Sacharoza – stabilizator, utrzymuje odpowiednią konsystencję szczepionki
- Etanol – konserwant, stabilizuje emulsję
- polisorbat 80 (tween 80, monooleinian polioksyetylenosorbitolu, E433) – emulgator pomagający w mieszaniu się składników hydrofobowych i hydrofilowych; używany jest również w kosmetykach
BUDOWA
Wektor szympansi ChAdOx1 został wcześniej użyty do stworzenia szczepionki przeciwko innemu beta-wirusowi z rodziny Koronawirusów (Coronaviridae) tj. MERS-CoV (ludzki koronawirus bliskowschodniego zespołu oddechowego). Tego typu szczepionki były testowane na modelach zwierzęcych w tym na wielbłądach, które są głównym rezerwuarem wirusa wywołującego MERS. Ponadto, przeprowadzono badania klinicznie na ludziach i w tamtej skali nie odnotowano poważnych skutków ubocznych. Odnotowano natomiast wzrost odporności na białko S wirusa MERS-CoV.3
Szczepionka AstraZeneca oparta jest o szympansi adenowirus Y25, ze względu na słabszą odpowiedź układu odpornościowego niż w przypadku ludzkiego adenowirusa. Ograniczało by to jego wnikanie do komórek osoby szczepionej (internalizację). Rozwijając tą myśl – na typowo ludzkie gatunki adenowirusów często występują swoiste przeciwciała we krwi ludzi. Według badań małpi wirus nie posiada takich ograniczeń. Ponadto, szczepionka nie posiada genów E1 i E3 szympansiego adenowirusa służących do replikacji jego materiału genetycznego.1,4
Budowa genomu adenowirusa 5,6,7
W przeciwieństwie do koronawirusów, których materiał genetyczny stanowi jednoniciowy RNA (ssRNA) adenowirusy posiadają dwuniciowy DNA (dsDNA).
W jego skład wchodzą:
a) Geny kodujące białka E (Early) wczesnej fazy :
- E1A – zaangażowane w proces replikacji wirusa
- E1B, E2A, E2B modyfikują genom wirusa. Białko E3 moduluje odpowiedź immunologiczną, blokuje syntezę interferonu i przedwczesną apoptozę. Białko E4 reguluje metabolizm wirusowego mRNA i wspomaga replikację DNA oraz wyłącza syntezę białek gospodarza. Natomiast, wszystkie dostarczają maszynerii do replikacji wirusowego DNA i następującej później transkrypcji genów późnej fazy. Ponadto, uczestniczą w blokadzie odpowiedzi immunologicznej (np. białko E1B hamuję przedwczesną apoptozę zakażonej komórki).
b) Białke pośredniej fazy – iX , IVa2 : strukturalne
c) Białka późnej fazy (Late – L) : L1-L5 są to białka strukturalne
d) ITR (inverted terminal repeats) – odwrócone powtórzenia końcowe – obecne są na końcach liniowej cząsteczki wirusa i pomagają w dwustronnym odczytywaniu sekwencji mRNA (na nici sensownej i antysensowenej)
Budowa szczepionki
- Sekwencja promotora genów natychmiastowych Cytomegalowirusa (CMV IE) – jest to sekwencja zawierająca promotor (tu: miejsce przyłączania polimerazy RNA) genów natychmiastowych ludzkiego cytomegalowirusa oraz zawierająca intron A. Jest ona często stosowana do ekspresji genów w biologii molekularnej ze względu na zwiększenie wydajności transkrypcji.3,4,8
- Sekwencja sygnałowa ludzkiego tkankowego aktywatora plazminogenu (tPA – tissue Plasminogen Activator) – białkowy produkt genu tPA uczestniczy w kaskadzie krzepnięcia krwi, a dokładniej przekształca plazminogen w jego aktywną formę – plazminę. Plazmina z kolei rozkłada fibrynę (włóknik stanowiący budulec skrzepu) rozpuszcając w ten sposób skrzep. Natomiast, sekwencja sygnałowa czyli jego fragment, została dodana w celu zaadresowania białka S do siateczki śródplazmatycznej, a następnie na zewnątrz komórki (ma charakter peptydu sygnałowego) i zwiększenia immunogenności. Po translacji ma długość 36 aminokwasów: MDAMKRGLCCVLLLCGAVFVSP|SQEIHARFRR|GARS. Wykazano, że dodatek sekwencji sygnałowej tPA powoduje wzmocnienie odpowiedzi immunologicznej w porównaniu do szczepionki bez sekwencji sygnałowej tPA. Następuje wzrost liczby przeciwciał – po 28 dniach od szczepienia w porównaniu ze szczepionką bez genu tPA (badanie wykonano na szczepionce przeciw MERS-CoV). 3,9-11
- Sekwencja genu S (Spike) SARS CoV-2 – kodująca białko S czyli glikoproteinę obecną na zewnątrz otoczki wirusa, umożliwiająca koronawirusowi na wnikanie do komórki poprzez łączenie się z domeną enzymatyczną ACE2. W teorii szczepienie ma spowodować ekkspresję (tworzenie) tego białka i powstanie odporności z wytworzeniem przeciwciał wobec białka S (anti-spike protein antibodies). W przypadku późniejszej infekcji przeciwciała neutralizują wirusa. Szczepionka przeciwko wirusowi MERS-CoV również zawierała gen białka S i tPA. Przy czym szczepionka ta wykazywała wyższy poziom przeciwciał neutralizujących niż bez tPA oraz wywoływała komórkową odpowiedź immunologiczną.3
- Sekwencja poliadenylacji z bydlęcego hormonu wzrostu – służy do zwiększenia wydajności procesu translacji i utrzymania stabilności mRNA.4,11
Podobnie jak w przypadku szczepionki mRNA firmy Pfizer, szczepionka firmy AstraZeneca posiada materiał genetyczny zoptymalizowany w taki sposób, aby zwiększyć wydajność translacji z utworzeniem białka S i jednocześnie bez zmiany sensu kodonu. Można było tak zrobić ponieważ, często kilka trójek nukleotydowych (kodonów) koduje ten sam aminokwas, a translacja przebiega wydajniej. Natomiast, w przeciwieństwie do szczepionek mRNA, nie modyfikowano reszt nukleotydowych DNA w ChAdOx1-S.8,12
JAK POWSTAŁA SZCZEPIONKA ASTRAZENECA ChAdOx1-S
Na początek należy wspomnieć, że wektory wirusowe namnażane są z wykorzystaniem maszynerii molekularnej ludzkich komórek. W przypadku ChAdOx1-S są to zmienione genetycznie ludzkie embrionalne komórki nerki (linia komórkowa T-REx-293, wyprowadzone z linii HEK293, wyizolowanej z zarodka ludzkiego pobranego w Danii. Linia komórkowa T-REx-293 dostarcza genu E1, w celu replikacji materiału genetycznego adenowirusa. 4,8,13
Wcześniej jednak za pomocą technologii rekombinacji DNA sporządzono konstrukt wektora. Pozbawiony jest on genów E1 i E3, odpowiedzialnych m.in. za replikację adenowirusa. W miejsce genu E1 posiada cały gen białka S wraz z sekwencją liderową ludzkiego tkankowego aktywatora plazminogenu (tPA). 1,4,8
Opis szczegółowy
Plazmid wahadłowy pShuttle2 zawierający sekwencję promotora cytomegalowirusa, sekwencję sygnałową tPA, genu kodującego białko kolca (Spike) SARS-CoV-2 i sygnał poliadenylacji został poddany trawieniu enzymami restrykcyjnymi w taki sposób, aby powstały gen heterologiczny posiadał sekwencję oskrzydlającą homologiczną do części sekwencji genomu Adenowirusa. Następnie gen heterologiczny poddano rekombinacji homologicznej z plazmidem bakteryjnym o dużej pojemności (tu: BAC) posiadającym gen propagacji, umożliwiający jego powielanie w komórkach bakterii. Rekombinacja homologiczna zachodzi po pobraniu plazmidu i kasety ekspresyjnej z genem S przez komórki kompetentnych bakterii E.coli (zdolnych do pobierania DNA z otoczenia). Plazmid BAC zawiera gen oporności na antybiotyk, co pozwala na selekcję tylko tych bakterii, które pobrały plazmid. 1,3,4,8,14
Pożywka dla E.coli zawiera ampicylinę, dzięki czemu tylko bakterie, które efektywnie pobrały plazmid BAC z otoczenia będą wstanie rosnąć na pożywce. Następnie, izoluje się powielony i zrekombinowany plazmid, a z jego sekwencji wycina się wnzymami restrykcyjnymi liniowy genom wektora adenowirusowego wraz z sekwencją genu S. Kolejnym krokiem jest wprowadzadzenie go do embrionalnych komórek nerki (komórek komplementujących) na drodze transfekcji. W rekombinowanych komórkach HEK293 (dokładniej w linii T-REx-293) DNA adenowirusa ulega ekspresji z utworzeniem białek. Brakujące geny niezbędne do replikacji materiału genetycznego wirusa uzupełnia genom adenowirusa obecny w DNA komórki (chromosom 19 z rejonem E1 i E3), ponieważ komórki HEK293 poddano transfekcji ludzkim adenowirusem C o serotypie 5 (Human adenovirus C serotype 5: HAdV-5). Jest to tzw. pomocniczy genom adenowirusa, który nie posiada genów odpowiedzialnych za powstanie białek strukturalnych.3,4,8,14
Powstają kapsydy wirusa, do których ładowany jest powielony zrekombinowany materiał genetyczny. Na tym etapie, powstaje gotowy wektor ChAdOx1-S, a powstająca szczepionka uwalniana jest do środowiska w wyniku lizy komórek embrionalnych skąd można ją wyizolować. Po 48 godzinach od zakażenia gotowy wektor jest oczyszczany z zawiesiny komórkowej metodą ultrawirowania w gradiencie gęstości z wykorzystaniem chlorku cezu (CsCl). Następnie, frakcję zawierającą wektor ChAdOx1-S poddaje się dializie przez błony półprzepuszczalne wobec buforu zawierajacego trisaminometan i sacharozę. Ostatnim etapem jest zawieszenie wektora w roztworze będącym medium dla szczepionki.1,4
Pewnym problemem przy produkcji szczepionek wektorowych opartych o adenowirus może być obecność części genomu ludzkiego adenowirusa, ponieważ istnieje szansa na zapakowanie genomu pomocniczego adenowirusa, który posiada geny E1 i E3. Ten nieporządany proces zachodzi u 0,1-10% przypadków. Można temu jednak zapobiec dzięki działaniu rekombinazy CRE (w komórkach HEK293) usuwającej sekwencję loxP z genomu adenowirusa w obrębie chromosomu 19 (rekombinacja CRE-Lox), co uniemożliwia pakowanie adenowirusów pomocniczych. 14
SPOSÓB DZIAŁANIA SZCZEPIONKI
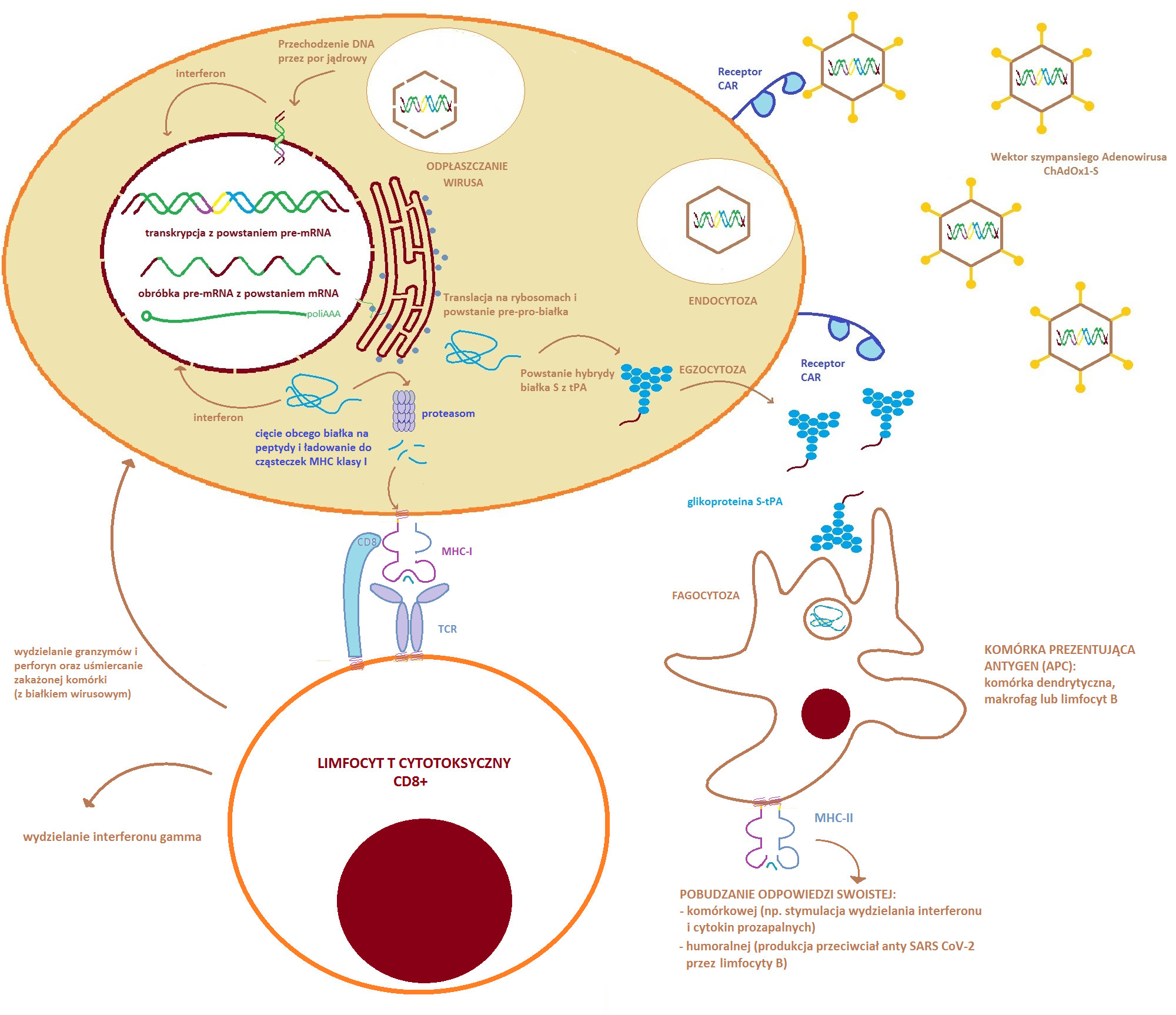
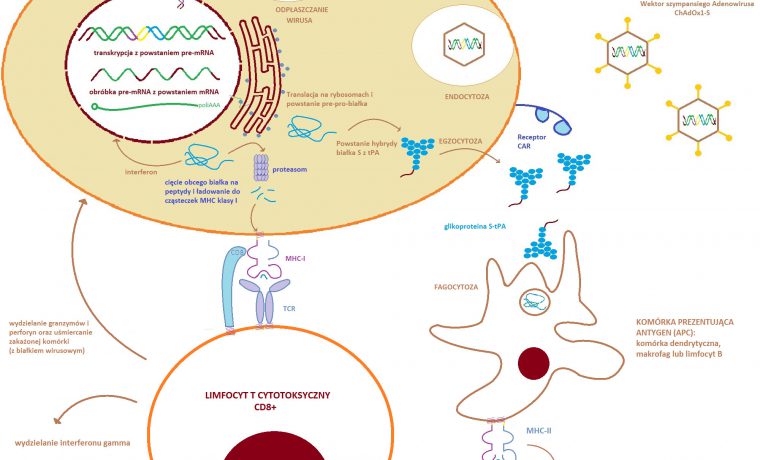
Szczepionkę AstraZeneca podaje się domięśniowo (w mięsień naramienny), tj. standardowo jak w przypadku większości szczepionek. Natomiast, w przeciwieństwie do szczepionek mRNA, szczepionki oparte o wektor adenowirusowy po wstrzyknięciu wnikają do komórek zawierających na swojej powierzchni receptor CAR (Coxsackievirus and adenovirus receptor). Receptor CAR stanowi tzw. wrota zakażenia dla większości adenowirusów (niektóre wykorzystują receptor CD46), który ekspresjonowany jest na powierzchni wielu komórek, w tym m.in. komórkach kory nadnerczy, mózgu, tkanki nabłonkowej, błony śluzowej jelit i nosa (odcinek odpowiadający za węch) czy prostaty. Natomiast, uważa się że w miejscu iniekcji wirus trafia głównie do obecnych tam komórek mięśniowych i fibroblastów oraz komórek prezentujących antygen (np. komórek dendrytycznych), które choć w mniejszym stopniu to również posiadają receptor CAR.7,9,15
Poza interakcją powierzchniowej glikoproteiny adenowirusa z receptorem CAR w internalizacji wirusa uczestniczą alfa integryny obecne na komórkach człowieka. Następuje endocytoza i odpłaszczanie (enkapsydacja) wirusa z uwolnieniem materiału genetycznego, który przez por jądrowy trafia do jądra komórkowego. Tam, zachodzi transkrypcja genów odpowiedzialnych za powstanie peptydu sygnałowego tkankowego aktywatora plazminogenu i glikoproteiny S SARS-CoV-2. Ekspresja genów wektora zachodzi pod kontrolą intronu A cytomegalowirusa. Powstaje pre-mRNA, który następnie ulega modyfikacjom potranskrypcyjnym. W związku z tym zachodzi wycięcie intronów, dołączana jest czapeczka guanylanowa i ogon poliA, po czym powstaje matryca RNA. Dojrzały mRNA przechodzi przez por jądrowy, a następnie ulega translacji na rybosomach (rybozymach). Jako pierwsza od końca aminowego białka powstaje sekwencja sygnałowa o charakterze peptydu sygnałowego. Jej obecność adresuje białko do siateczki śródplazmatycznej, gdzie zostaje odcięta. 3,7,11,13
Na dalszym etapie powstała hybryda białka S z częścią sekwencji sygnałowej tPA ulega fałdowaniu do osiągnięcia konformacji z przed fuzji (przed zakażeniem komórki wirusem SARS CoV-2) i wydzieleniu na zewnątrz. Jednakże zarówno materiał genetyczny zrekombinowanego adenowirusa jak i powstające białko mogą pobudzać mechanizmy odporności nieswoistej np. poprzez aktywację genów odpowiedzialnych za syntezę interferonu. Jeśli nie dojdzie do wydzielenia białka S, może ono zostać również pocięte na krótkie peptydy. Następnie trafiło by do cząsteczek MHC klasy I. Odpowiadają one za “informowanie” limfocytów T cytotoksycznych (CD8+) o zakażeniu (lub transformacji nowotworowej). Dochodzi wtedy do indukcji apoptozy (programowanej śmierci) zainfekowanej komórki. Na tym etapie jest to już aktywacja elementów swoistej odpowiedzi immunologicznej.4,8
Jeżeli jednak białko S zostanie wydzielone na zewnątrz komórki to po napotkaniu przez komórkę prezentującą antygen (APC) ulegnie ono fagocytozie. Następnie po proteolizie kawałki antygenu (białka S) zostaną zaprezentowane w najbliższym węźle chłonnym limfocytom T pomocniczym (CD4+). Stymulują one aktywację limfocytów B do produkcji przeciwciał neutralizujących białko S. Podobnie jak w przypadku osób po przebytym zakażeniu, gdy powstaną limfocyty B i T pamięci dochodzi do powstania odporności mogącej trwać nawet wiele lat. Natomiast przy ponownym kontakcie z antygenem, przeciwciała IgG rozpoznają go, co wywołuje szybką i silną odpowiedź immunologiczną. Wyjątek stanowią osoby z obniżoną odpornością lub biorące immunosupresanty.16
SKUTECZNOŚĆ SZCZEPIONKI
Skuteczność po podaniu pojedynczej dawki szczepionki wynosi 76% (od 59,3-85,9) w czasie od 22 do 90 dni od podania. Natomiast, po podaniu drugiej dawki najwyższą skuteczność szczepionki odnotowano w przypadku długiego okresu przerwy (powyżej 84 dni/12 tygodni). Wyniosła ona 81,3% (60,3-91,2%) w porównaniu z 55,1% skutecznością (33,0-69,9%) w czasie krótszym niż 6 tygodni. Są to dane dla osób w wieku od 18 do 55 lat, z niewielką przewagą mężczyzn niż kobiet. 17
Szczepionkę wektorową ChAdOx1-S stosuje się u osób powyżej 18 roku życia, ponieważ jest ona lepiej tolerowana przez starsze osoby. Poza tym, niektóre kraje ograniczyły lub wycofały stosowanie tej szczepionki ze względu na skutki uboczne występujące u osób młodych. Do krajów europejskich z ograniczeniem stosowania do pacjentów powyżej 60 roku życia należą Belgia, Włochy i Hiszpania (artykuł The Guardian). 18,19
Skuteczność wobec nowych wariantów
Szczep B.1.1.7 (tzw. wariant brytyjski) – posiada insercje asparaginy na tyrozynę w pozycji 501 (mutacja N501Y) – według badań konsorcjum Genomics w Wielkiej Brytanii (projekt AMPHEUS) szczepionka ChAdOx1-S wykazuje mniejszą skuteczność wobec szczepu B.1.1.7 o około 10%. Jednakże w lutym odkryto kolejną mutację tj. E484K, co budzi niepokój odnośnie skuteczności szczepionki ChOxAd1-S jak i innych.20
Szczep B.1.351 (tzw. wariant południowoafrykański) – posiada insercję lizyny na asparaginę w pozycji 417 (K417N), insercję kwasu glutaminowego na lizynę (E484K) oraz m.in. insercję asparaginy na tyrozynę w pozycji 501 (mutacja N501Y) w sekwencji glikoproteiny kolca (w domenie wiążącej receptor ACE2). W lutym rząd RPA zawiesił dostawy szczepionki firmy AstraZeneca ze względu na niewielką skuteczność u osób młodych. Potwierdziły to również badania według których skuteczność wobec wariantu południowoafrykańskiego wyniosła 10,4% (badanie przeprowadzono u osób zaszczepionych dwiema dawkami, u których nie wykryto infekcji ludzkim wirusem niedoboru odporności – HIV).21
Szczep P1/B.1.1.28 (tzw. wariant brazylijski) – posiada zmianę 10-ciu aminokwasów w sekwencji glikoproteiny kolca, w tym mutacje K417T (zamiana lizyny na treoninę), E484K i N501Y. W badaniach nad zdolnością neutralizacji wariantu brazylijskiego przez przeciwciała wytworzone zarówno po szczepieniu (m.in. preparaty ChAdOx1-S, BNT162b2) jak i w wyniku powstania naturalnej odporności, wykazywały obniżenie powinowactwa przeciwciał na ten wariant. Jednakże skuteczność i tak była wyższa niż w przypadku ochrony przed wariantem południowoafrykańskim.22
SKUTKI UBOCZNE (NIEPOŻĄDANE ODCZYNY POSZCZEPIENNE) 2
Jak podaje ulotka do preparatu Vaxzevria po podaniu szczepionki odnotowuje się działania niepożądane. 2
Bardzo często (u więcej niż jednej osoby na 10) występują:
- zaburzenia rytmu serca
- duszność
- świszczący oddech
- mdłości oraz wymioty
- uczucie omdlenia lub oszołomienia
- obrzęk ust, twarzy lub gardła
- pokrzywka lub wysypka
- ból brzucha.
Często (u nie więcej niż jednej na 10 osób):
- obrzęk lub zaczerwienienie w miejscu wstrzyknięcia
- gorączka (>38°C)
- wymioty lub biegunka
- mała liczba płytek krwi
Niezbyt często (u nie więcej niż jednej na 100 osób):
- senność lub zawroty głowy
- zmniejszony apetyt
- powiększone węzły chłonne
- nadmierne pocenie się, swędzenie skóry lub wysypka
Bardzo rzadko (u nie więcej niż jednej na 10000 osób):
- zakrzepica organów związana z zatorami naczyń krwionośnych (np. mózg, wątroba, śledziona, jelita) w połączeniu z obniżoną ilością płytek krwi (trombocytopenia)
Częstość nieznana (nie można określić częstości na podstawie dostępnych danych):
- ciężka reakcja alergiczna (wstrząs anafilaktyczny)
- nadwrażliwość
Ze względu na wysoką śmiertelność związaną z przypadkami zakrzepicy małopłytkowej (szczególnie poważna jest zakrzepica żył mózgowych) oraz na kontrowersje z tym związane poniżej skupiłem się na opisie tego schorzenia.
Wywołana szczepionką immunologiczna małopłytkowość zakrzepowa (VITT – Vaccine-Induced Immune Thrombotic Thrombocytopenia)
W wyniku działania szczepionki czasem dochodzi do aktywacji płytek krwi (trombocytów) i do aktywacji kaskady krzepnięcia krwi (tworzenie skrzepu). Jak podaje ulotka (patrz wyżej) objawy zakrzepicy pojawiają się z częstością nie większą niż jedna na 10000 osób, natomiast według danych naukowych częstość VITT wynosi 1/100000 szczepień, w grupie osób poniżej 50 roku życia. Dla przykładu badania pani doktor Niny Haagenrud Schultz (i innych) przeprowadzone w Norwegii wykazały częstotliwość wystąpienia schorzenia na poziomie 5 przypadków na 132686 wykonanych szczepień (wyłącznie pierwszą dawką) wśród pacjentów będących pracownikami służby zdrowia w wieku 32 – 54 lat. Jeśli jednak taka choroba wystąpi to jej śmiertelność wynosi 60%, z większą częstością u kobiet i z przewagą młodych osób.2,23-25
Jak podaje Europejska Agencja Leków (EMA – European Medicines Agency), w większości przypadków do objawów zakrzepicy przeważnie dochodzi od tygodnia do dwóch od dnia podania pierwszej dawki szczepionki u zdrowych osób. Zakrzepica obejmować może wiele narządów i układów (OUN, płuca, śledziona i przewód pokarmowy), zakrzepicę dużych naczyń krwionośnych (zakrzepica zatoki żylnej, zakrzepica żyły wrotnej, tętnicy udowej, tętnicy szyjnej wspólnej czy żyły śledzionowej). Występowały również poważne przypadki zakrzepicy zatok jamistych. Pojawiają się również krwawienia, wybroczyny oraz niewydolność wielonarządowa. Gdy skrzep powstaje w naczyniach krwionośnych mózgu to dochodzi do zatrzymania jego dotlenienia. Następnie objawem jest ból głowy, zmęczenie i zatrzymanie funkcji mózgu. Co w konsekwencji prowadzi do śmierci organizmu. Natomiast, uważa się, że małopłytkowość występuje wtórnie na skutek zakrzepicy, ponieważ płytki krwi biorą udział w tworzeniu skrzepu krwi. 9,23,24,26
W badaniu diagnostycznym obserwuje się podwyższony poziom białka C-reaktywnego (CRP, jedno z białek ostrej fazy), obniżenie poziomu płytek krwi (wg. badań przeprowadzonych przez doktorów Greinacher’a i Thiele’a – z wahaniami w zakresie 9000-107000), podwyższony poziom D-dimerów (fragmenty włóknika), a także wzrost poziomu γ-glutamylotransferazy (GGTP), a także aminotransferazy alaninowej (ALT) i asparaginowej (AST). 24
W badaniach Greinacher’a i Thiele’a (publikacja z 26 kwietnia 2021) wykazano, że pacjenci mają dodatni test na przeciwciała przeciw kompleksowi heparyna-czynnik płytkowy 4 (PF4), podobnie jak w przypadku małopłytkowości poheparynowej. Jednakże, pacjenci którym nie podawano heparyny wykazywali tutaj również dodatni wynik testu na reaktywność przeciwciał wobec czynnika płytkowego 4 (bez udziału heparyny). Kompleks PF4 z przeciwciałami aktywuje płytki krwi, które wydzielają czynniki prozakrzepowe i większe ilości czynnika PF4, co w konsekwencji przyczynia się do powstawania zakrzepicy. 24
Powyższe objawy oraz odnotowane przypadki idiopatycznej plamicy małopłytkowej (ITP – idiopathic thrombocytopenic purpura) i zapalenia tarczycy Hashimoto (choroba Hashimoto) świadczą o udziale przeciwciał w powstawaniu objawów zakrzepicy małopłytkowej, dlatego chorobę nazywa się również immunologiczną zakrzepicą małopłytkową wywołaną szczepionką (VITT – Vaccine-Induced Immune Thrombotic Thrombocytopenia). 9, 24
Dla sprawdzenia udziału kapsydu wektora adenowirusowego podano szczepionkę ChAdOx1-S, co również wywołało pewne zwiększenie reaktywności płytek krwi, wiadomo jednak że sam adenowirus również jest zdolny do wiązania się do trombocytów i ich aktywacji (poprzez przeciwciała neutralizujące). Jednakże, obecność nieinternalizowanej szczepionki po tygodniu lub dwóch od dnia szczepienia, nie wydaje się mieć tutaj znaczenia. 24
Udział sekwencji sygnałowej tkankowego aktywatora plazminogenu
Tkankowy aktywator plazminogenu (tPA) – został użyty w szczepionce jako sekwencja sygnałowa, kierująca białko S na drogę egzocytozy (wydzielniczą). Badania wykazały przy tym, że dodanie genu tPA wzmacnia immunogenność rekombinowanych antygenów. Jednakże uważa się, że może mieć on udział w układzie krzepnięcia krwi, a przez to w powstawaniu autoimmunologicznej zakrzepicy małopłytkowej. Zazwyczaj taka sekwencja o charakterze peptydu sygnałowego ulega wycięciu w pobliżu aminokwasu z krótką grupą funkcyjną (tutaj: seryna) przez peptydazę sygnałową znajdującą się po wewnętrznej stronie błony szorstkiej siateczki śródplazmatycznej (RER). Jeśli jednak nie dojdzie do odcięcią peptydu sygnałowego to takie białko może zostać zakotwiczone w błonie komórki bez wydzielenia na zewnątrz. 9,11
Jak wspomniano wcześniej sewkencja tPA powstająca w wyniku translacji zawiera 36 aminokwasów: MDAMKRGLCCVLLLCGAVFVSP|SQEIHARFRRGARS. Spośród nich peptyd sygnałowy stanowi: MDAMKRGLCCVLLLCGAVFVSP. Natomiast, kolejna część: SQEIHARFRRGARS jest propeptydem, którego odcięcie w probiałku tPA odpowiada za jego fałdowanie do aktywnej formy. Po odcięciu peptydu sygnałowego, sekwencja propeptydu tPA pozostaje na N-końcu białkia S co według badań zwiększa odpowiedź immunologiczną organizmu. 3,9,27
Niestety nie znalazłem badań dotyczących podobieństwa sekwencji aminokwasowej białka fuzyjnego tPA-Spike_SARS2 do czynnika płytkowego 4 (PF4), które wskazywałoby na przyczynę powstania autoprzeciwciał anty-PF4. Z tego powodu postanowiłem skorzystać z narzędzia “align” (program Clustal Omega) w bazie uniprot.org dodając sekwencje N-końcową tPA (jak wyżej) do sekwencji aminokwasowej białka S (pierwotny izolat z Wuhan) zgodnie z sekwencją białka fuzyjnego powstającego po translacji szczepionki ChAdOx1-S. Jak widać na rysunku poniżej, część sekwencji aminokwasowej jest identyczna do PF4, zwłaszcza na N-końcu, gdzie występuje pozostałość po odcięciu peptydu sygnałowego tPA. Ponadto, aminokwasy w obrębie sekwencji homologicznej mają taki sam charakter, co teoretycznie mogło by być przyczyną powstania autoimmunizacji na PF4.28

Sekwencja następujących aminokwasów może mieć tu znaczenie w rozwoju immunologicznej zakrzepicy małopłytkowej: MFVFLVLLPLV oraz QCVNLTTRTQLPPAYTNSFTR (niewielkie dopasowanie). Pierwsza z nich daje duże dopasowanie, ale jest krótka, natomiast druga z nich daje częściową homologię i występuje wyłącznie w sekwencji białka S. Jednakze powstanie przeciwciał krzyżowych, tj. swoistych wobec glikoproteiny S i PF4 tłumaczyło by, dlaczego dochodzi do tworzenia kompleksu przeciwciał z czynnikiem płytkowym 4 i do aktywacji trombocytów poprzez fragment Fcγ autoprzeciwciał. Możliwe, że dzieje się to w obecności białka S, ponieważ do przypadków VITT dochodzi ok. 10 dni po pierwszej dawce. Większa immunogenność tPA wydaje się jednak niestety pomagać w tym procesie.24,28
Istnieje również możliwość powstania przeciwciał anty-glikoproteina kolca z częściową homologią do sekwencji tkankowego aktywatora plazminogenu, co obniżało by proces powstawania enzymu plazminy. Jeśli plazmina nie jest aktywowana to skrzep jego rozkład jest bardzo powolny, co prowadziło by do zakrzepicy. Natomiast, jeśli chodzi o obniżenie ilości płytek krwi (trombocytów) to biorą one udział w postawaniu skrzepu. Skrzep składa się z m.in. włóknika (fibryny), fosfolipidów i płytek krwi, które stabilizują siatkę białek fibrynowych.24
Jak stwierdziła Europejska Agencja Leków: “silna ekspresja i wydzielanie dużej ilości białka kolca, per se, może powodować zakrzepy krwi u osób predysponowanych, zwłaszcza w połączeniu z wywoływaniem silnej odpowiedzi immunologicznej na białko S”. Dlatego, potrzeba rzetelnych badań dotyczących innych szczepionek, zwłaszcza opartych o inny mechanizm (mRNA lub proteinowe) czy występują podobne przypadki zakrzepicy. Jeśli tak to w czy w podobnym stopniu.9
Leczenie
Pacjentów z zakrzepicą można wyleczyć podając im dożylnie przeciwciała blokujące wiązanie autoreaktywnych gammaglobulin z receptorem Fcγ na powierzchni trombocytów. Ponadto, poprawę widać po podaniu antagonistów witaminy K. Podawać należy również leki przeciwzakrzepowe (antykoagulantów), ale inne niż heparyna (wyjątek to negatywny wynik reaktywności anty heparyna-PF4) oraz trombocytów dożylnie.24
PODSUMOWANIE
Szczepionka wektorowa Astra Zeneca (ChAdOx1-S) w rzadkich przypadkach może przyczynić się do powstania zakrzepicy małopłytkowej. Ze względu na to osoby, które po szczepieniu mają takie objawy jak duszność, uczucie bólu w klatce piersiowej, ból brzucha, obrzęk nóg, silne bóle głowy, niewyraźne widzenie lub wybroczyny pojawiające się poza miejscem szczepienia powinny niezwłocznie zgłosić się do lekarza. Ponadto, powinno się wyeliminować czynnik powodujący autoimmunizację. Jak podano wyżej szczepionka AstraZeneca, podobnie jak inne często są mało skuteczne na nowe warianty. Czasem również poniżej naturalnej odporności po przebytym zakażeniu. Dlatego powinno się rozważyć wszystkie za i przeciw przy stosowaniu niedokładnie przebadanych preparatów. Zwłaszcza, że istnieje alternatywa szczepionki peptydowej z ekologicznymi składnikami oraz leki, które stosuje się od lat. Są to leki zarówno syntetyczne jak i ziołowe (omówiono je w innym artykule). 9,24
LITERATURA
1. jaki to jest adenowirus: Dicks MD, Spencer AJ, Edwards NJ, et al. A novel chimpanzee adenovirus vector with low human seroprevalence: improved systems for vector derivation and comparative immunogenicity. PLoS One. 2012;7(7):e40385. doi:10.1371/journal.pone.0040385
3. Alharbi NK, Padron-Regalado E, Thompson CP, Kupke A, Wells D, Sloan MA, Grehan K, Temperton N, Lambe T, Warimwe G, Becker S, Hill AVS, Gilbert SC. ChAdOx1 and MVA based vaccine candidates against MERS-CoV elicit neutralising antibodies and cellular immune responses in mice. Vaccine. 2017 Jun 27;35(30):3780-3788. doi: 10.1016/j.vaccine.2017.05.032. Epub 2017 Jun 1. PMID: 28579232; PMCID: PMC5516308.
5. https://bch.cbd.int/database/record.shtml?documentid=115611
7. Sylwia Rynans, Tomasz Dzieciątkowski, Grażyna Młynarczyk: Zakażenia adenowirusami u pacjentów z zaburzeniami odporności. Katedra i Zakład Mikrobiologii Lekarskiej, Warszawski Uniwersytet Medyczny. Postępy Hig. Med. Dosw. 2013; 67 : 964-972.
10. Kou Y, Xu Y, Zhao Z, Liu J, Wu Y, You Q, Wang L, Gao F, Cai L, Jiang C. Tissue plasminogen activator (tPA) signal sequence enhances immunogenicity of MVA-based vaccine against tuberculosis. Immunol Lett. 2017 Oct;190:51-57. doi: 10.1016/j.imlet.2017.07.007. Epub 2017 Jul 17. PMID: 28728855.
11. prof. dr hab. Joanna Bereta: Wykłady z Biosyntezy białek. Wydział Biochemii, Biofizyki i Biotechnologii. 2020, Uniwersytet Jagielloński.
12. Neeltje van Doremalen, Lambe, Teresa Spencer, A. et al. ChAdOx1 nCoV-19 vaccine prevents SARS-CoV-2 pneumonia in rhesus macaques. Nature 586, 578–582 (2020). https://doi.org/10.1038/s41586-020-2608-y
13. https://www.medexpress.pl/szczepionka-astrazeneca-przeciw-sars-cov-2/80535
14. Shomu’s biology: Gene therapy using adeno virus. https://www.youtube.com/watch?v=WTrkURar1ow&ab_channel=Shomu%27sBiology [dostęp: 02.05.2021]
15. https://bgee.org/?page=gene&gene_id=ENSG00000154639
16. Witold Lasek, Jakub Gołąb, Marek Jakóbisiak, Tomasz Stokłosa. Immunologia. PWN; Rok wydania: 2013.
17. Voysey M, Costa Clemens SA, Madhi SA, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials [published correction appears in Lancet. 2021 Mar 6;397(10277):880]. Lancet. 2021;397(10277):881-891. doi:10.1016/S0140-6736(21)00432-3
18. Maheshi N Ramasamy, DPhil, Angela M Minassian, DPhil, Katie J Ewer, PhD, Amy L Flaxman, DPhil, Pedro M Folegatti, MD, Daniel R Owens, MRCPCH et al. Oxford COVID Vaccine Trial Group. Safety and immunogenicity of ChAdOx1 nCoV-19 vaccine administered in a prime-boost regimen in young and old adults (COV002): a single-blind, randomised, controlled, phase 2/3 trial. Lancet. 2021 Dec 19;396(10267):1979-1993. doi: 10.1016/S0140-6736(20)32466-1.
19. The Guardian: “Spain, Belgium and Italy restrict AstraZeneca Covid vaccine to older people”. 8 April 2021. Retrieved 11 April 2021.
20. Angela Betsaida B. Laguipo. “Oxford-AstraZeneca vaccine effective against B.1.1.7 SARS-CoV-2 variant“. News Medical. 31 marca 2021.
21. Madhi SA, Baillie V, Cutland CL, et al. Efficacy of the ChAdOx1 nCoV-19 Covid-19 Vaccine against the B.1.351 Variant [published online ahead of print, 2021 Mar 16]. N Engl J Med. 2021;NEJMoa2102214. doi:10.1056/NEJMoa2102214
22. Dejnirattisai W, Zhou D, Supasa P, et al. Antibody evasion by the P.1 strain of SARS-CoV-2 [published online ahead of print, 2021 Mar 30]. Cell. 2021;S0092-8674(21)00428-1. doi:10.1016/j.cell.2021.03.055
23. SHOMU’S BIology: Covid 19 vaccine blood clot risk | Astrazeneca vaccine side effects https://www.youtube.com/watch?v=Im-WxMiN4Z4&ab_channel=Shomu%27sBiology [dostęp: 02.05.2021]
24. Andreas Greinacher, M.D., Thomas Thiele, M.D., Theodore E. Warkentin, M.D., Karin Weisser, Ph.D., Paul A. Kyrle, M.D., and Sabine Eichinger, M.D. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. The new england journal of medicine, April 9, 2021 DOI: 10.1056/NEJMoa2104840
25. Schultz NH, Sørvoll IH, Michelsen AE, et al. Thrombosis and thrombocytopenia after ChAdOx1 nCoV-19 vaccination. N Engl J Med. 9 kwietnia 2021. DOI: 10.1056/NEJMoa2104882
26. Dinah V Parums. Editorial: SARS-CoV-2 mRNA Vaccines and the Possible Mechanism of Vaccine-Induced Immune Thrombotic Thrombocytopenia (VITT). Med Sci Monit. 2021;27:e932899. Published 2021 Apr 26. doi:10.12659/MSM.932899
27. Sekwencja aminokwasowa tPA https://www.uniprot.org/uniprot/P00750
28. https://www.uniprot.org/align/A2021050472FEB3358BE035486EE75ADE9E917725003C42D